Új korszak küszöbén állunk? Már van lehetséges alternatíva az antibiotikumokra
A közegészségügyben az utóbbi időben egyik leggyakrabban előforduló kihívás az antibiotikumokkal szembeni rezisztencia. Ennek kialakulása tulajdonképpen egyidős a baktériumokkal, tehát nem újkeletű jelenségről van szó, azonban terjedését nagyban elősegíti, ha túlzottan és helytelenül, indokolatlanul alkalmazzuk az antibiotikumokat. A rezisztencia kialakulása természetes válasz a baktériumokban az antibiotikumok alkalmazása során. De mit tehetünk, hogy megelőzzük azt? Hogyan érhetjük el, hogy az antibiotikumos kezelés valóban hatásos legyen, miközben minimalizáljuk a rezisztencia kialakulásának esélyét? Létezik-e alternatíva az antibiotikumokra? (Elöljáróban eláruljuk, hogy igen.) Ezekre a kérdésekre kerestük a választ dr. Papp Judit mikrobiológussal és dr. Kovács Levente genetikussal, a Babeş–Bolyai Tudományegyetem Biológia és Geológia Kar oktatóival.
Dr. Papp Judit az antibiotikum-rezisztencia mikrobiológiai aspektusai szempontjából, míg dr. Kovács Levente elsősorban a baktériumok genetikai felépítésével, mutációival kapcsolatos kérdésekre választolt.
Az antibiotikumok működése
Az antibiotikumok több szinten hathatnak, sőt átfedések is lehetnek ezekben a hatásokban vagy mechanizmusokban – mondta Papp Judit, miközben kifejtette, hogy vannak olyan antibiotikumok, amelyek a sejtfalszintézist gátolják meg, aminek következtében a baktériumok sejtfala nem lesz funkcionális. Egy másik hatásmechanizmus a plazmamembránok károsítása, ez baktériumok és gombák ellen egyaránt hatásos lehet. Bizonyos vegyületek gátolják a membránalkotók képződését, mások pórusokat képeznek a membránokban, és ezáltal a sejt különböző szállítási folyamatai szenvednek zavart. És vannak olyan antibiotikumok, amelyek a genetikai anyag replikációját gátolják meg, illetve olyanok is, amelyek a baktériumsejt fehérjeszintézisét gátolják.
„Alapvetően ezek a főbb támadási pontok: a sejtfal, a membrán, a nukleinsav- és fehérjeszintézis. De vannak olyan kemoterápiás szerek, amelyek valamilyen anyagcsereutat gátolnak, például a vitaminok szintézisét, amelyek létfontosságúak a baktériumok fejlődése szempontjából” – ismertette a részleteket.
Papp Judit megjegyezte továbbá, hogy az antibiotikumok szelektív toxicitással rendelkeznek és ilyen értelemben javasolt olyan antibiotikumok használata, amelyek minél kisebb kórokozócsoportot céloznak meg, viszont ezt nem minden esetben lehet alkalmazni. Ha van idő arra, hogy például garatváladékból kitenyésszék a kórokozó mikroorganizmust és megvizsgálják az antibiotikumokkal szembeni érzékenységét, amelyre célzott terápiát lehet előíni, az nagy előny, ha viszont fennáll a szepszis (vérmérgezés) kockázata, akkor azonnal kell cselekedni. Ilyen esetekben úgynevezett széles spektrumú antibiotikumokat alkalmaznak, amelyek a szepszist okozó lehetséges baktériumokat minél nagyobb sikerrel szorítják vissza. Ennek hátránya, hogy ezek adott esetben a normál bélmikrobiomot alkotó baktériumokat is megtizedelik. Ennek ellensúlyozására javasolják a probiotikumok vagy az erjesztett tejtermékek alkalmazását.
Hogyan alakulhat ki az antibiotikum-rezisztencia?
Az eredeti antibiotikumok természetes anyagok, amelyeket a különböző mikroorganizmusok, baktériumok, gombák termelnek más mikroorganizmusok ellen. Ezek az antimikrobiális anyagok szabályozzák a különböző mikrobiális populációkat: egyrészt jelmolekulákként működnek, illetve bizonyos gátló hatásuk is van. Ennek megfelelően az antibiotikum-rezisztencia is ősi sajátosság. Az antimikrobiális anyagok stressztényezőkként hatnak a mikroorganizmusokra, amelyek a túlélésük érdekében minden stressztényezővel, így az antibiotikumokkal szemben is védekeznek. Ennek megfelelően a rezisztencia is régebben kialakult sajátosság, viszont fokozódó problémát az antibiotikumok gyógyászatban való használata, illetve helytelen és indokolatlan alkalmazása miatt jelent – hívta fel a figyelmünket Papp Judit.
A természetes rezisztencia azt jelenti, hogy a mikroorganizmus eleve ellenálló bizonyos antimikrobiális anyagokkal, akár antibiotikumokkal szemben is – mondta. Ennek több oka is lehet, például a sejtfal vagy a membrán felépítése nem teszi lehetővé az antimikrobiális anyag bejutását a baktériumba.

Dr. Papp Judit a Babeş-Bolyai Tudományegyetem Biológiai és Geológia karának adjunktusa. Egyetemi tanulmányait a BBTE Biológia és Geológia karán végezte, majd ugyanitt doktori fokozatot szerzett. Általános mikrobiológiát, orvosi mikrobiológiát és környezeti mikrobiológiát oktat. Kutatási területe a mikrobiális biofilmek tanulmányozásával kapcsolatos.
De nemcsak természetes, hanem úgynevezett szerzett rezisztencia is létezik, ez mutáció következtében jelenik meg, vagyis a mikroorganizmus génállományában alakulnak ki olyan módosulások, amelyek aztán rezisztenssé teszik egy adott antibiotikummal szemben. A másik lehetőség, hogy rezisztenciagéneket kapnak más mikroorganizmusoktól, ezt nevezik horizontális géntranszfernek, amikor a rezisztenciát biztosító DNS-darabok a mikroorganizmusokba kerülnek, és ezek adják aztán az ellenállóképességüket.
Kovács Levente hangsúlyozta, hogy a rezisztencia kialakulása evolúciós folyamat, ami a baktériumok vagy egyéb mikroorganizmusok esetében rendkívül gyorsan történik. Ennek oka, hogy – az embertől vagy más magasabbrendű állatoktól eltérően, amelyek esetében két példányban van meg mindegyik gén – a legtöbb baktérium génjei csak egyetlen példányban állnak rendelkezésre.
„Hogyha ezekben a génekben valamilyen változás megy végbe, az azonnal megnyilvánul. Az emberi szervezetben ezzel szemben, ha egy gén egyik változata mutálódik, rendszerint még mindig ott van a második, korábbi változat. A legtöbb esetben ahhoz, hogy egy mutáció hatása az emberben megnyilvánuljon, a másik változatnak is el kell romolnia, vagy mindkét szülőjétől mutáns változatot kell örökölnie. Tehát nálunk hosszabb a genetikai mutációkon keresztül történő alkalmazkodási folyamat” – magyarázta a kutató. Erre példaként említette az ember esetében a laktóz emésztésének képességét. Ez is mutáció révén alakult ki: nem volt megfelelő táplálék, ezért fogyasztottuk a tejet, és a mutációnak köszönhetően ma sokunk felnőttkorban is meg tudja emészteni azt. Viszont ez az alkalmazkodás nálunk több évezreden át tartó folyamat révén történt. A baktérumoknál ez nagyságrendekkel gyorsabb.
De a baktériumok esetében miért történik a mutáció ilyen gyorsan? Mert ők sokan vannak, csak egy példányban tartalmazzák génjeiket és nagyon gyorsan szaporodnak. „Amíg nálunk, embereknél egy generáció legalább 20-30 év, az a baktériumok esetében akár 20 perc lehet, azaz ilyen gyorsan osztódhatnak. A mutációk teszik lehetővé olyan baktériumok kialakulását, amelyek rezisztensek az antibiotikumokra. Amíg a nem rezisztens társait elpusztítja az antimikrobiális vegyület, addig a rezisztens túléli és ezért gyorsabban el tud szaporodni” – mondta a kutató.
Papp Judit ehhez kapcsolódóan hívta fel a figyelmet, hogy egy adott antibiotikumra érzékeny populációban viszonylag rövid idő alatt a rezisztenciát kifejlesztő baktériumok fognak dominálni. Ez a jelenség áll annak a hátterében, hogy kórházi környezetben, ahol sok antibiotikumot használnak és állandó az antibiotikum-stressz a baktériumok számára, robbanásszerűen jelennek meg rezisztens baktériumtörzsek.
De van egy másik probléma, ami az antibiotikum-rezisztencia kialakulását fokozza: az állattenyésztésben alkalmazott antibiotikumok. Ezeket prevenciós céllal alkalmazzák, mivel sok állatot tartanak viszonylag kis helyen, így előzik meg, hogy bizonyos fertőzések terjedjenek – ennek elsősorban gazdasági okai vannak.
„Megfigyelték, hogy a szarvasmarhák esetében az antibiotikumoknak hozamnövelő hatása is van. Erre van egy érdekes adat: az Egyesült Államokban a teljes antibiotikum-felhasználás 80 százaléka az állattenyésztésből származik. De, ami a legnagyobb baj, hogy az ott használt antibiotikumok 70 százaléka megegyezik az emberek kezelésében, a kórházakban használt antibiotikumokkal. Például, ha egy farmról származó rezisztens Salmonella törzs fertőz meg egy embert, esetében valószínűleg azokat az antibiotikumokat már nem lehet használni, amiket az állatfarm használt” – részletezte Kovács Levente, hozzátéve, hogy ezek a rezisztens baktériumok visszakerülnek a környezetbe, talajokba, vizekbe. Éppen ebből az okból az Európai Unió még 2016-ban betiltotta a hozamnövekedést elősegítő antibiotikum-alkalmazást. A fejlődő országokban azonban nincsenek ilyen szabályozások.
Hogy eshetünk át a ló túloldalára?
Kovács Levente kifejtette, az antibiotikumos kezelés akkor okoz nagy problémát, ha gyenge a beteg szervezete, kórházban kezelik, és már rezisztens baktériumokkal fertőződött meg. Nagyon fontos kérdés a dózis: egy baktérium úgy lesz rezisztens, ha a baktériumpopuláció folyamatosan kis dózisban találkozik az antibiotikummal, ebben az esetben nem pusztul el az összes kórokozó, lesz néhány, amely túléli az antibiotikum okozta stresszt és evolúciósan fejleszti magát, ennek következményeként lehet, hogy ha nagyobb dózissal, későbbi időpontban kezelnék a beteget, akkor a baktérium már előnnyel indul. De a kórházi környezettől eltávolodva, az otthoni szedésre felírt antibiotikumok helytelen használata is vezethet rezisztens baktériumok kialakulásához.
„Éppen ezért, ha az orvos tíz napig tartó antibiotikumos kezelést ír fel, hiába érzi a beteg már a harmadik napon jobban magát, végig kell csinálnia a tíznapos kúrát, hogy az a néhány életben maradt baktérium is, amely addig ellen tudott állni, elpusztuljon. Így kisebb az esélye annak, hogy egy új rezisztens baktérium jelenik meg” – mutatott rá Kovács Levente.

Dr. Kovács Levente a Babeş-Bolyai Tudományegyetem Biológiai és Geológia karának adjunktusa. Egyetemi tanulmányait a BBTE Biológia és Geológia karán végezte, majd doktori fokozatot szerzett a Szegedi Tudományegyetem Biológus Doktori iskolájában. Ezt követően összesen 7 évig volt a Cambridge-i Egyetem Genetika Intézetének majd a California Institute of Technology Biológia és Biomérnöki intézetének posztdoktor kutatója. 2023 óta a BBTE oktatója és saját kutatólaborjában genetikai betegségek modellezését végzi.
Papp Judit hozzátette, hogy ezzel szemben a kórházi környezet tulajdonképpen az antibiotikum-rezisztencia kialakulásának melegágya, mert ott immunkompromittált, műtött, esetleg súlyos alapbetegségekben szenvedő páciensek vannak. Az antibiotikumokat prevenciós céllal is használják a műtétek után, annak megelőzésére, hogy olyan fertőzések jelenjenek meg, amelyek gyorsan szepszist idézhetnek elő.
„A kórházakban gyakorlatilag állandó az antibiotikum-stressz, és ezért sokszor a baktériumok is ezekhez az antibiotikum-kombinációkhoz alkalmazkodnak, és így alakulnak ki aztán a multirezisztens baktériumok, amelyek több antibiotikum-csoporthoz, vagy több szinten ható antibiotikumokhoz alkalmazkodnak és ellenállóvá válnak. De megjelenthetnek a pánrezisztens baktériumok is, amelyek gyakorlatilag minden antibiotikummal szemben ellenállók” – tudtuk meg Papp Judittól.
A kutatók konkrét példákat is említettek: vannak bizonyos baktériumfajok, például a Klebsiella, a Mycobacterium, az Acinetobacter és a Staphylococcus, amelyek kifejezetten alkalmasak arra, hogy rezisztenssé váljanak. És vannak olyanok is, amelyeknek ártalmatlan fajai jelen vannak a környezetben, viszont a klinikai törzsei között már rezisztensek is vannak, ilyenek egyes Serratia fajok. Ezekkel az a gond, hogy normális körülmények között az egészséges szervezetet nem betegítik meg, de kórházi környezetben veszélyesek a legyengült betegekre.
Hogyan vizsgálják a rezisztenciát?
Papp Judit ismertette: a biológiai mintából – például garatváladék, széklet vagy vizelet – kitenyésztett kórokozó esetén úgynevezett antibiogram segítségével lehet meghatározni, hogy egy adott fertőzést okozó baktériumtörzs melyik antibiotikumra érzékeny. Ilyenkor derülhet ki az is, hogy rezisztens-e az adott baktérium, és az orvosok ennek megfelelően tudnak kezelési stratégiát választani. Antibiogram elkészítésére van kapacitás a romániai kórházak laboratóriumaiban.
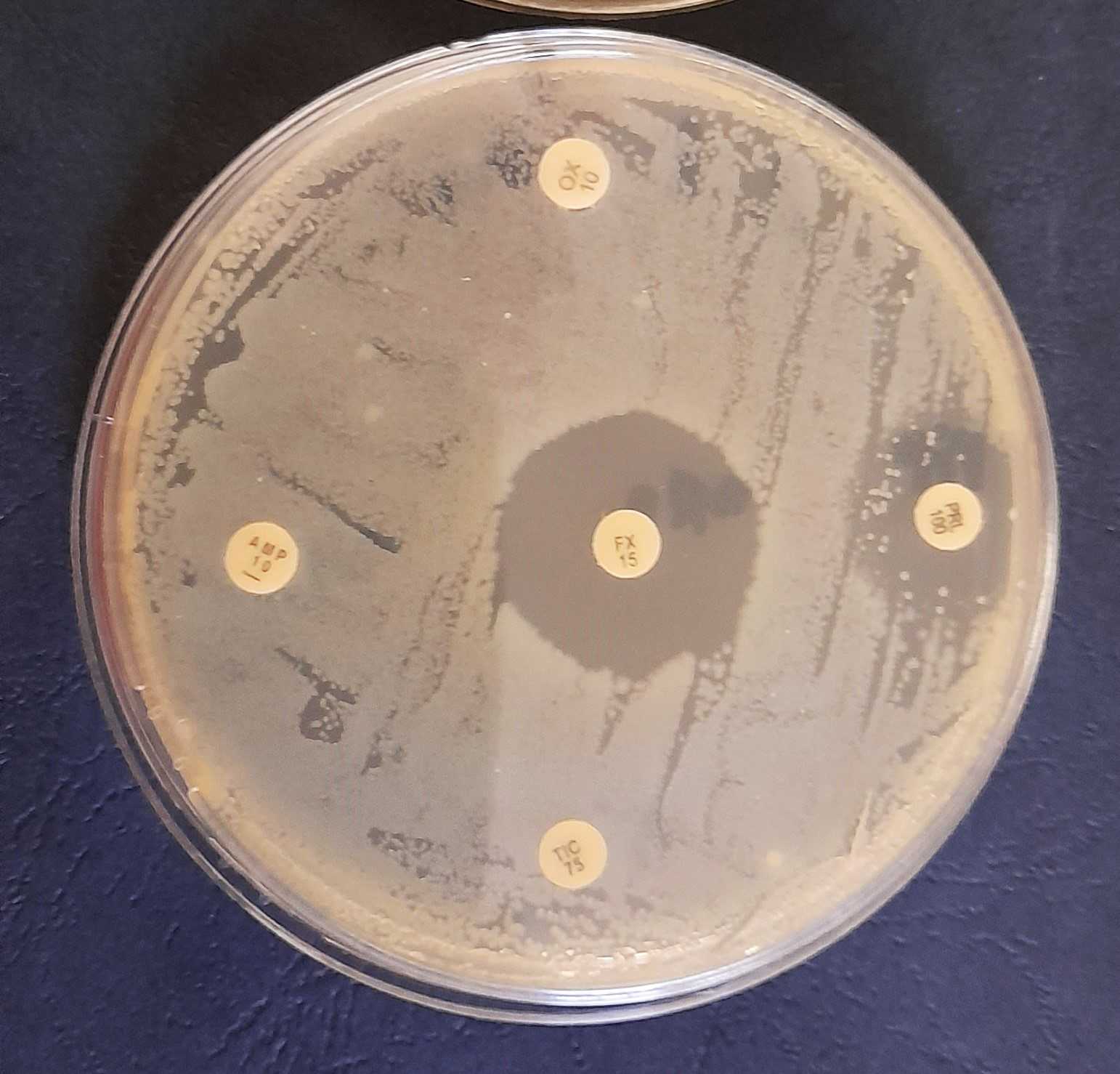
Beszélgetésünk során megtudtuk, hogy a Szegedi Biológiai Kutatóközpont Biokémiai intézetének munkatársai feltérképezték, milyen többlet erőfeszítéssel jár a baktériumnak, ha egy adott antibiotikummal szemben rezisztenciát fejleszt ki. Megfigyelték, hogy ha rezisztenssé válik egy adott típusú szerrel szemben, milyen más típusú antibiotikumra válik érzékenyebbé, akár még a normálisnál is érzékenyebbé. Más kutatók azt is megfigyelték, hogy bizonyos antibiotikumokra rezisztens baktériumok az emberi szervezet által termelt antimikrobiális fehérjékre érzékenyebbek. Tehát az emberi szervezetben is vannak olyan vegyületek, amelyek korlátozzák a baktériumok szaporodását.
Van alternatíva az antibiotikumokra
A baktériumfertőzések kezelése terén forradalmi újítás az úgynevezett fágterápia. Ez a kifejezés baktériumokat fertőző vírusok, más néven bakteriofágok használatát takarja – hívták fel a figyelmünket.
„Ez ígéretes, mert a fágok nem az emberi szervezetet fertőzik meg, csak a benne élő baktériumot, kórokozót. A hátrányuk az, hogy ezek a vírusok annyira specifikusak, hogy csak bizonyos baktériumtörzsek ellen hatásosak. Ugyan a baktériumtörzs nehezen tud védekező mechanizmust kifejteni, nem válik olyan könnyen rezisztenssé, viszont nagyon pontosan kell tudni, hogy melyik törzs fertőzte meg a beteget. Ez tulajdonképpen korlátozza is a fágok alkalmazását” – mondta Kovács Levente.
A hatékony fágterápián dolgoznak a Szegedi Biológiai Kutatóközpont Biotechnológiai Nemzeti Laboratóriumának munkatársai. Egyelőre nehéz kórházi körülmények között meghatározni, hogy a fertőzést okozó baktérium melyik típusú fágra érzékeny. A fágokat nem lehet olyan könnyen és gyorsan előállítani, mint az antibiotikumokat, de a szegedi kutatók erre a problémára is látnak egy lehetséges megoldást: szeptember végén a neves Cell című folyóiratban közzétett tanulmányukban ismertették, hogy a fágterápiát régiósan is lehet alkalmazni. Több magyarországi kórház mellett temesvári és marosvásárhelyi egészségügyi intézmények is közreműködtek a kutatásban, és kiderült, hogy egy adott régióban általában egy típusú fágra érzékeny baktériumtörzs terjed el, és az is marad domináns abban a térségben körülbelül öt-hat évig.
„Ez már jó jel, mert ha tudjuk pontosan, hogy melyik kórházban mely fágok hatásosak, akkor minden kórházat el lehet látni öt-hat típusú fággal. A cikk adatai szerint az esetek 80 százalékában hatékonyan működhet ez a stratégia. Úgy tűnik, van rá jó alternatíva, hogy felvegyük a harcot az antibiotikum-rezisztenciával” – mutatott rá Kovács Levente.
Miért lenne ez jó? – tette fel a kérdést a kutató, meg is adva rá a választ: azért, mert az antibiotikum-rezisztencia kialakulásának feltétele, hogy az antibiotikumok jelen legyenek a környezetben. „Tegyük fel, hogy ha globálisan úgy 20 évre abbahagynánk az antibiotikumok alkalmazását és fágokkal kezelnék a betegeket, akkor utána vissza lehetne térni az antibiotikumokra, mert a fágterápia megtizedelné a rezisztens törzseket” – hangzott el.
(Címlapkép: Illusztráció | Chokniti Khongchum/Pexels)
CSAK SAJÁT

















.jpg)



