FRISSÍTVE - Az Európai Gyógyszerügynökség jóváhagyta a Pfizer-BioNTech-vakcinát
Az Európai Gyógyszerügynökség (EMA) forgalmazásra ajánlotta hétfőn az Európai Unióban a Pfizer és a BioNTech vállalatok által az új típusú koronavírus ellen közösen kifejlesztett oltóanyagot. FRISSÍTÉS: Nincs bizonyíték arra, hogy az oltás nem véd a SARS-CoV-2 új törzse ellen.
Az EU gyógyszerfelügyeleti hatóságának szerepét betöltő ügynökség gyorsított eljárás keretében hozta meg döntését, amely az oltóanyag egyéves feltételes alkalmazásához adja meg a zöld jelzést.
A forgalomba hozatalt hivatalosan az Európai Bizottság engedélyezi, a testület várhatóan rövid időn belül bejelenti jóváhagyását.
43 ezren vettek részt a klinikai vizsgálatokban
Az Európai Gyógyszerügynökség igazgatója szerint az amerikai gyógyszeripari és a német biotechnológiai vállalat oltóanyagának előnyei „messze felülírják” a lehetséges kockázatokat. Emer Cooke a sajtótájékoztatóján emlékeztetett arra, hogy a klinikai vizsgálatok során 43 ezer embert teszteltek, és az ügynökség elsődleges szempontja annak megállapítása volt, hogy biztonságos-e a vakcina. Az oltás 16 éves kortól alkalmazható.
Hozzátette: nincs semmilyen tudományos bizonyíték arra, hogy ez az oltóanyag nem ad védelmet a SARS-CoV-2 koronavírus új változata ellen, amely jelenleg elsősorban Nagy-Britanniában terjed. Szavait Marco Cavaleri, a testület oltási stratégiával és egészségvédelemmel foglalkozó egységének a vezetője is megerősítette.
Cooke hangsúlyozta, hogy a vakcina hatásainak nyomonkövetése is nagyon fontos biztonságossági szempontból, így az ügynökség továbbra is folyamatosan gyűjteni és elemezni fog minden olyan adatot, amely az oltóanyagnak a beoltott emberekre gyakorolt hatásait vizsgálja.
Mint mondta, az egyéves feltételes forgalomba hozatali engedély azt is biztosítja, hogy az oltóanyagot kifejlesztő vállalatoknak szigorított jogi kötelezettségei vannak arra nézve, hogy minden ezzel kapcsolatos adatot eljuttassanak az EMA-hoz felülvizsgálat céljából.
Arra is kitért, hogy az ügynökség átlátható információkat tesz közzé honlapján a minősítés folyamatáról, és ez magában foglalja a már előzőleg kiértékelt klinikai adatokat.
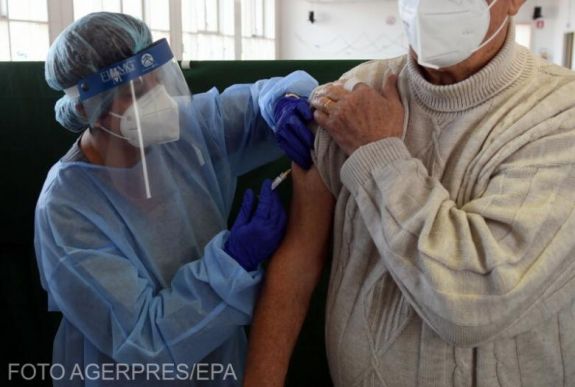
Beoltás után is be kell tartani a járványügyi szabályokat
Az igazgató felhívta a figyelmet, hogy a vakcina magában nem sokat ér, ha a lakosok nem oltatják be magukat, ezért tudományosan megalapozott információkra van ahhoz szükségük, hogy megbízzanak az EMA értékelésében. Arra is figyelmeztetett, hogy a lakosoknak a beoltás után is követniük kell a hatályos távolságtartási és higiéniai előírásokat, mivel az oltóanyag önmagában nem „csodaszer”.
Sabine Strauss, az ügynökség gyógyszerbiztonsági tanácsának elnöke arra mutatott rá, hogy hatalmas felelősség van az ügynökség vállán, így az oltóanyag biztonságosságával kapcsolatos minden adatot és információt feltétlenül ellenőrizni kell.
Arra ösztönözte az unió egészségügyi szakembereit, hogy minden esetben tegyenek jelentést az oltóanyag lehetséges mellékhatásairól, az ezzel kapcsolatos adatokat az EMA összegyűjti és megvizsgálja. Felhívta a figyelmet, hogy az unió kiváló monitorrendszerrel és a legmodernebb elemzési eszközökkel rendelkezik ahhoz, hogy minden, az oltóanyag biztonságosságával kapcsolatos új információt megvizsgáljanak. Strauss ugyanakkor hangsúlyozta: az elemzéseik szerint nem lehet ok aggodalomra az oltóanyag biztonságosságával kapcsolatban.
Harald Enzman, az EMA emberi felhasználásra szánt gyógyszereket vizsgáló bizottságának elnöke elmondta, hogy korlátozott számú adatokkal rendelkeznek az oltóanyag várandós nőkön való alkalmazásával kapcsolatban, ezért ennek megvizsgálásra eseti megközelítést fognak használni.
Az Európai Gyógyszerügynökség január első hetében dönt egy másik gyógyszercég, a Moderna által a koronavírus ellen kifejlesztett vakcina forgalomba hozatalának támogatásáról.
(Címlapfotó: Agerpres/EPA)












_(1).jpg)


